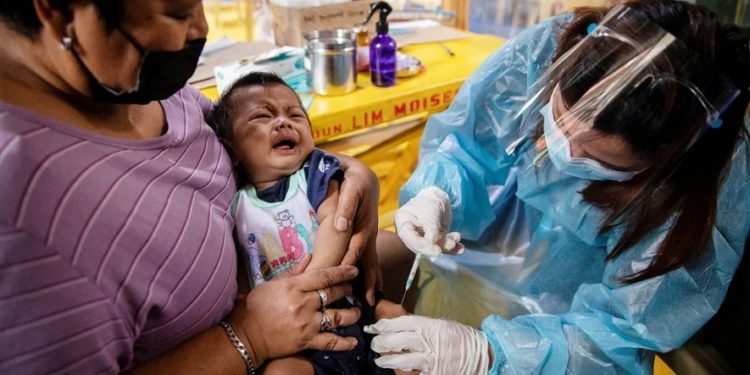
La Administración de Fármacos y Alimentos de Estados Unidos (FDA por su sigla en inglés) esperará a contar con más datos antes de decidir si aprueba el uso de emergencia de la vacuna de Pfizer para los niños menores de cinco años.
Así lo apuntó la FDA en un comunicado en el que explica que ha notificado a Pfizer que va a analizar nuevos datos relativos a su vacuna, en concreto sobre los efectos de la tercera dosis, para decidir sobre el uso en el grupo de menor edad de la población.
Ante tal situación, el regulador ha pospuesto la celebración del panel de expertos que tenía previsto celebrar el próximo 15 de febrero para discutir el uso de esta vacuna en los más pequeños, para tener más tiempo para revisar los nuevos datos antes de debatir sobre esta medida.
En el comunicado, la FDA explica que la extensión de la variante ómicron y el notable incremento de hospitalizaciones de los más pequeños hasta sus niveles más altos de toda la pandemia llevan a la conclusión de que hay que estudiar “todas las opciones posibles” antes de tomar ninguna decisión.
Por eso quieren averiguar si dos dosis son suficientes para proteger a este grupo de edad.
Respuesta de Pfizer
Al respecto, Pfizer comunicó que pospuso el pedido de habilitación que había realizado ante la FDA y resaltó que va a esperar a sus informes sobre las terceras dosis de la vacuna para menores de 5 años.
En un comunicado, el laboratorio detalló que está convencido de que “tres dosis pueden dar un nivel de protección más alto para este grupo etario”, y adelantó que los datos de esos estudios estarán disponibles en abril.
La FDA recalcó que se asegurará de que los datos demuestran que la vacuna es efectiva y segura antes de aprobarla.
Y mientras tanto insistió en que la mejor manera que tienen los adultos de proteger a los más pequeños es vacunándose y siguiendo las recomendaciones de distancia social y uso de mascarillas.
Vía EFE